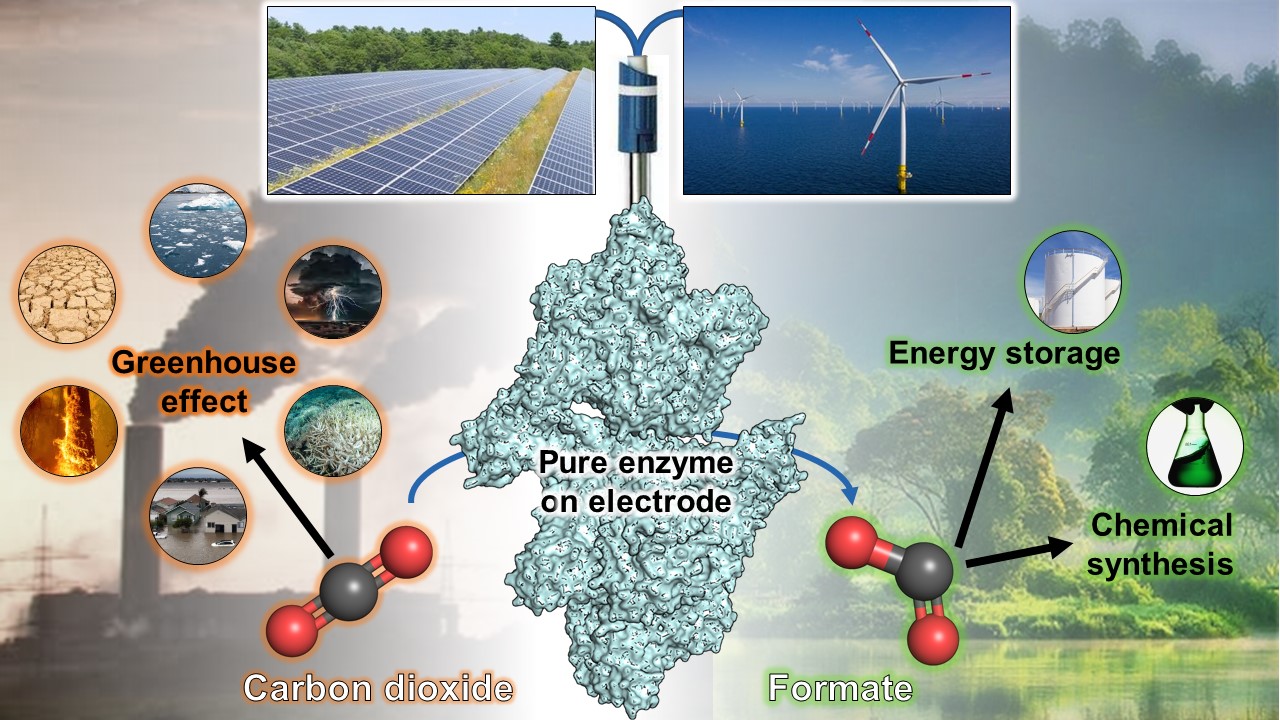
Die Erderwärmung wird getrieben durch den fortwährenden menschengemachten Ausstoß von Treibhausgasen. Viele Forschende beschäftigen sich daher damit, wie aus den Treibhausgasen nützliche Produkte werden können. Kohlendioxid (CO2) etwa sammelt sich in der Atmosphäre an und ist schwer umzuwandeln, da es chemisch sehr stabil ist. Einige Mikroben schaffen es dennoch, das CO2 mit Hilfe hocheffizienter Enzyme einzufangen. Forschende des Max-Planck-Instituts für Marine Mikrobiologie in Bremen haben zusammen mit den Universitäten Genf und Radboud eines dieser Enzyme isoliert. Als sie das Enzym auf einer Elektrode elektronisch aufspannten, beobachteten sie die äußerst effiziente Umwandlung von CO2 in Ameisensäure (Formiat). Die Entdeckung ist wichtig für die Entwicklung neuer Systeme zur CO2-Bindung, da sie erstaunlich effizient und kaum umkehrbar ist. Die Ergebnisse erscheinen jetzt in der Zeitschrift „Angewandte Chemie“.
Auf der Suche nach Mikroorganismen, die effizient CO2 binden
„Die von den Mikroorganismen verwendeten Enzyme ermöglichen sehr spezifische und schnelle Reaktionen und sind daher eine fantastische Spielwiese für Forschende“, sagt Tristan Wagner, Leiter der Max-Planck-Forschungsgruppe Mikrobielle Metabolismen am Max-Planck-Institut für Marine Mikrobiologie (MPIMM).
Einige dieser Enzyme binden CO2 auf besonders interessante Art: Sie wandeln es in Ameisensäure um, eine stabile und ungefährliche Verbindung, die benutzt werden kann, um Energie zu speichern oder Moleküle für Industrie und Pharmazie herzustellen. Ein Beispiel dafür ist die Methan produzierende Mikrobe Methermicoccus shengliensis, die in einem Ölfeld entdeckt wurde und bei 50 °C wächst. Julia Kurth und Cornelia Welte an der Radboud-Universität in den Niederlanden haben diese Mikrobe kultiviert und untersucht. Am Max-Planck-Institut für Marine Mikrobiologie haben Olivier Lemaire, Mélissa Belhamri und Tristan Wagner die Mikrobe genau analysiert, um ihr CO2-bindendes Enzym zu finden und zu messen, wie schnell und effizient sie CO2 umwandeln kann.
CO2-Umwandlung mit großem Potenzial
Die Max-Planck-Forschenden unternahmen die schwierige Aufgabe, das mikrobielle Enzym zu isolieren. „Wir wussten, dass solche Enzyme sauerstoffempfindlich sind. Deshalb mussten wir, um es von anderen Proteinen zu trennen, unter einer sauerstofffreien Haube ohne Umgebungsluft arbeiten – ziemlich kompliziert, aber es ist uns gelungen“, so Lemaire.
Nach der Isolierung ging es an die Charakterisierung der Eigenschaften des Enzyms. Dabei zeigte sich, dass es CO2 effizient in Ameisensäure umwandelt, die umgekehrte Reaktion aber nur sehr langsam und mit geringer Ausbeute durchführt.
„Ähnliche Enzyme aus der Familie der Ameisensäure-Dehydrogenasen sind dafür bekannt, dass sie in beide Richtungen arbeiten. Wir haben nun gezeigt, dass das Enzym von Methermicoccus shengliensisnahezu unidirektional ist und die Ameisensäure nicht effizient in CO2 zurückverwandelt werden kann“, berichtet Belhamri. „Dieses Phänomen, das nur auftritt, wenn kein Sauerstoff vorhanden ist, hat uns ziemlich begeistert“, fügt sie hinzu. „Dass die bei der CO2-Fixierung entstehende Ameisensäure nicht zurückverwandelt werden kann und sich daher anreichert, ist äußerst interessant für ein mögliches CO2-Abscheidungs-System, vor allem, wenn wir es auf einer Elektrode aufspannen könnten“, betont Wagner.
Der Vorteil dabei ist: Wenn das Enzym an eine Elektrode gebunden ist, wird die zum Einfangen des CO2 nötige „Energie“ direkt von der Elektrode geliefert, ohne Stromverluste oder den Bedarf an teuren oder giftigen chemischen Verbindungen als Relais. Die enzymgebundenen Elektroden sind also sehr effiziente und attraktive Systeme, um Gase umzuwandeln. Wagner und sein Team schickten das gereinigte Enzym daher an die Universität Genf, um ein elektrodenbasiertes CO2-Abscheidungssystem zu entwickeln.
Gasumwandlung mit Strom
Selmihan Sahin und Ross Milton von der Universität Genf sind Spezialisten auf dem Gebiet der Elektrochemie. Sie nutzen Elektroden, die mit elektrischem Strom verbunden sind, um chemische Reaktionen durchzuführen. Die elektrodengestützte Gewinnung von Ameisensäure aus CO2 benutzt oft umweltschädliche und seltene Metalle. Diese Metalle wollten sie durch das Enzym ersetzen, das Wagner und seine Gruppe am MPIMM entdeckt und gewonnen hatten. Oft ist es ein aufwändiges Verfahren, Enzyme an Elektroden zu binden. Das Enzym aus Wagners Forschungsgruppe jedoch hat spezifische Eigenschaften, die den Vorgang erleichtern könnten. Tatsächlich gelang es den Forschenden aus der Schweiz, das Enzym auf einer Graphitelektrode zu befestigen, wo es die Gasumwandlung durchführte. Die gemessenen Umsatzraten waren mit denen vergleichbar, die mit klassischen Ameisensäure-Dehydrogenasen erzielt werden. „Die Stärke dieses an die Elektrode gekoppelten biologischen Systems liegt darin, wie effizient es die Elektronen von der Elektrizität auf die CO2-Umwandlung überträgt“, betont Lemaire. Sahin und Milton konnten auch bestätigen, dass das System die umgekehrte Reaktion kaum durchführt, wie zuvor im Reagenzglas beobachtet. Die modifizierte Elektrode wandelte also das Treibhausgas laufend in Ameisensäure um, ohne, dass nachweisbare Nebenprodukte entstanden oder elektrischer Strom verlorenging.
Auf neuen Wegen der Nutzung von CO2 aus der Atmosphäre
Die gemeinsame Forschungsarbeit stellt der Wissenschaft ein neues molekulares Werkzeug zur Verfügung: ein Enzym, das CO2 sehr effizient durch Übertragung von Elektrizität umwandelt. Der Strom für das elektrodenbasierte System könnte aus erneuerbaren Energien kommen. Aus dem CO2 entsteht Ameisensäure – ein Molekül, das direkt oder zur Energiespeicherung genutzt werden kann.
„Vor uns hat noch niemand versucht, ein Enzym von einer solchen methanogenen Mikrobe für eine elektrodenbasierte Gasumwandlung zu nutzen“, sagt Tristan Wagner. „Dabei sind Methanogene von Natur aus hervorragende Gasumwandler“.
So leistungsfähig sie aber auch sein könnten – um Enzyme im großen Maßstab für technische Prozesse einzusetzen, muss auch die Enzymproduktion im entsprechenden Maßstab stattfinden, was erhebliche Investitionen erfordert. Obwohl die entdeckte Strategie also theoretisch die CO2-Umwandlung deutlich verbessern könnte, sind vor ihrer Anwendung noch weitere umfassende Forschungen zum Enzymmechanismus erforderlich. Deswegen machen sich die Forschenden nun daran, die molekularen Geheimnisse der Reaktion gründlich zu entschlüsseln.
Originalveröffentlichung
Selmihan Sahin*, Olivier N. Lemaire*, Mélissa Belhamri, Julia M. Kurth, Cornelia U. Welte, Tristan Wagner, Ross D. Milton (2023): Bioelectrocatalytic CO2 Reduction by Mo-Dependent Formylmethanofuran Dehydrogenase. Angew. Chem. Int. Ed. (15 Sept 2023), e202311981.
DOI: https://doi.org/10.1002/anie.202311981
*Beide Autoren haben gleichwertig beigetragen
Source
Max-Planck-Insitut, Pressemitteilung, 2023-09-28.
Supplier
Angewandte Chemie (Journal)
Max Planck Institute for Marine Microbiology
Max Planck Society
Radboud University, Nijmegen (NL)
University of Geneva
Share
Renewable Carbon News – Daily Newsletter
Subscribe to our daily email newsletter – the world's leading newsletter on renewable materials and chemicals









